Waarvoor wordt Stelara gebruikt ?
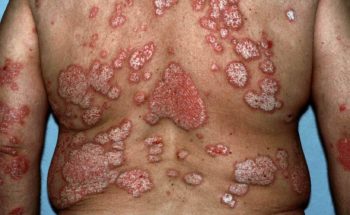
Stelara wordt toegepast bij de behandeling van volwassen patiënten met matige tot ernstige chronische plaque-psoriasis die geen respons hebben gegeven op, of een contra-indicatie hebben voor, of intolerant zijn voor andere systemische therapieën inclusief ciclosporine, methotrexaat en PUVA.
Wat is Stelara ?
Stelara is een geheel humane IgG1K-monoklonaal antilichaam en werkt als remmer tegen de interleukines 12 en 23. Interleukine 12 en 23 zijn boodschapper eiwitten die vrijkomen bij ontstekingsprocessen in de huid van patiënten met psoriasis. Hierdoor kan het middel specifiek aangrijpen op processen die verantwoordelijk zijn voor de huidverschijnselen bij psoriasis. Het actieve geneesmiddel heet “ustekinumab”; Stelara ® is de merknaam.
How wordt Stelara toegediend ?
Het middel wordt subcutaan (onderhuids) toegediend. Aanvangsdosis is 45 mg subcutaan toegediend in week 0, gevolgd door een dosis van 45 mg in week 4 en vervolgens iedere 12 weken. Voor patiënten met een lichaamsgewicht zwaarder dan 100 kg is de dosis 90 mg, subcutaan toegediend in week 0, gevolgd door een dosis van 90 mg in week 4 en vervolgens iedere 12 weken.
GENEESMIDDELINFORMATIE
Elke flacon bevat 45 mg ustekinumab in 0,5 ml oplossing.
Wat zijn de verwachte resultaten van Stelara ?
Uit studies is gebleken dat meer dan 2/3 van de patiënten een significante verbetering zagen in week 12 (dus 8 weken na de tweede injectie). Patiënten die vervolgens op een onderhoudsbehandeling werden gezet behielden deze goede reactie tot tenminste week 76.
Wat zijn de mogelijke bijwerkingen van Stelara ?
ZEER VAAK VOORKOMENDE BIJWERKINGEN (bij ≥ 1/10)
Voornamelijk een nasofaryngitis (verkoudheid) en infecties van de bovenste luchtwegen. De meeste werden beschouwd als mild en waren geen reden om de onderzoeksbehandeling te stoppen.
VAAK VOORKOMENDE BIJWERKINGEN WAREN (bij ≥ 1/100 TOT < 1/10):
Ontsteking van onderhuids bindweefsel (cellulitis), virusinfectie van de bovenste luchtwegen, depressie, duizeligheid, hoofdpijn, keelpijn, verstopte neus, diarree, jeuk, rugpijn, spierpijn, vermoeidheid, roodheid op de injectieplaats.
SOMS (bij ≥ 1/1.000 TOT < 1/100):
-Infecties. In gecontroleerde studies bij psoriasispatiënten waren de percentages infecties of ernstige infecties bij patiënten behandeld met Stelara en degenen behandeld met placebo vergelijkbaar. De gemelde ernstige infecties waren ontsteking van onderhuids bindweefsel (cellulitis), diverticulitis (darmontsteking), osteomyelitis (botontsteking), virusinfecties, gastro-enteritis (maag-darmontsteking), pneumonie (longontsteking) en urineweginfecties. In klinische studies ontwikkelden patiënten met latente tuberculose die tegelijkertijd werden behandeld met isoniazide geen tuberculose.
-Kwaadaardige nieuwvormingen. In de klinische studies bij psoriasis was de incidentie van kwaadaardige nieuwvormingen (zoals inwendige kankers en huidkankers) gemeld bij patiënten behandeld met Stelara vergelijkbaar met de incidentie verwacht in de algemene populatie.
-Overgevoeligheidsreacties. In klinische studies met Stelara zijn huiduitslag en netelroos elk waargenomen bij < 2% van de patiënten.
Waar moet u op letten als u Stelara gebruikt ?
CONTRAINDICATIES VOOR STELARA
-Overgevoeligheid voor het werkzame bestanddeel of voor één van de hulpstoffen.
-Klinisch belangrijke, actieve infectie.
INFECTIES.
Stelara kan mogelijk het infectierisico vergroten en latente infecties reactiveren. In klinische studies zijn bij patiënten die Stelara kregen ernstige bacteriële, schimmel- en virusinfecties waargenomen. Voorzichtigheid dient in acht te worden genomen indien het gebruik van Stelara wordt overwogen bij patiënten met een chronische infectie of een voorgeschiedenis van recidiverende infectie. Alvorens een behandeling met Stelara te beginnen, dient te worden nagegaan of de patiënt tuberculose (TBC) heeft. Stelara mag niet worden gegeven aan patiënten met actieve TBC. Behandeling van latente TBC dient te worden begonnen vooraleer Stelara wordt toegediend. Behandeling tegen TBC dient ook te worden overwogen alvorens Stelara te beginnen bij patiënten met een voorgeschiedenis van latente of actieve TBC bij wie een adequate behandelkuur niet kan worden bevestigd. Patiënten die Stelara krijgen dienen tijdens en na de behandeling nauwgezet te worden gecontroleerd op verschijnselen en symptomen van actieve TBC. Patiënten dienen geïnstrueerd te worden om medische hulp te vragen als er verschijnselen of symptomen optreden die wijzen op een infectie. Als een patiënt een ernstige infectie ontwikkelt, dient de patiënt nauwgezet te worden gecontroleerd en Stelara dient niet toegediend te worden totdat de infectie is verdwenen.
KWAADAARDIGE NIEUWVORMINGEN
Afweermodulerende middelen zoals Stelara kunnen mogelijk de kans op kwaadaardige nieuwvormingen vergroten. Sommige patiënten die Stelara in klinische studies kregen, ontwikkelden huidkankers en inwendige kankers. Er zijn geen studies uitgevoerd met patiënten met kanker in de voorgeschiedenis of waarin de behandeling werd voortgezet bij patiënten die kanker ontwikkelden terwijl ze Stelara kregen. Derhalve dient men voorzichtig te zijn wanneer men het gebruik van Stelara bij deze patiënten overweegt.
OVERGEVOELIGHEIDSREACTIES
Als er een anafylactische reactie of een andere ernstige allergische reactie optreedt, dient de toediening van Stelara onmiddellijk te worden beëindigd en dient een passende therapie te worden ingesteld.
VACCINATIES
Het wordt aanbevolen levende virale of levende bacteriële vaccins (zoals Bacillus Calmette Guérin (BCG)) niet tegelijk toe te dienen met Stelara. Er zijn geen specifieke studies uitgevoerd bij patiënten die recentelijk levende virale of levende bacteriële vaccins hadden ontvangen. Voor een vaccinatie met levende virussen of levende bacteriën dient de behandeling met Stelara na de laatste dosis ten minste 15 weken te worden onderbroken en kan deze op zijn vroegst 2 weken na de vaccinatie worden hervat. Patiënten die Stelara krijgen toegediend, mogen wel tegelijkertijd geïnactiveerde of niet-levende vaccinaties krijgen.
GELIJKTIJDIGE BEHANDELING MET AFWEERREMMENDE MIDDELEN
De veiligheid en werkzaamheid van Stelara in combinatie met andere afweerremmende middelen, waaronder biologische geneesmiddelen, of fototherapie, zijn niet onderzocht. Men dient voorzichtig te zijn wanneer gelijktijdig gebruik van andere afweerremmende middelen en Stelara wordt overwogen of bij het overschakelen van andere afweerremmende biologische geneesmiddelen.
SPECIALE POPULATIES
-Kinderen en adolescenten (< 18 jaar). Stelara wordt ontraden voor gebruik bij kinderen jonger dan 18 jaar wegens gebrek aan gegevens over de veiligheid en werkzaamheid.
-Ouderen (≥ 65 jaar). Er zijn over het algemeen geen verschillen waargenomen in werkzaamheid of veiligheid bij patiënten van 65 jaar en ouder die Stelara kregen ten opzichte van jongere patiënten. Omdat er bij de oudere populatie in het algemeen een hogere incidentie van infecties is, dient men voorzichtig te zijn bij het behandelen van ouderen.
-Lever- en nierinsufficiëntie. Er zijn geen specifieke studies uitgevoerd bij patiënten met lever- en nierinsufficiëntie
Wanneer dient u uw arts te waarschuwen ?
Waarschuw uw arts of apotheker indien bij u een bijwerking optreedt die niet wordt vermeld in de bijsluiter.
Download
Meest recente bijsluiter Stelara voorgevulde spuit 45 mg (CBG)
Meest recente bijsluiter Stelara voorgevulde spuit 90 mg (CBG)
Vindt u dit artikel nuttig?
Vraag het de huidarts
De meest gestelde vragen over Psoriasis op een rijtje.- Kan een persoon meerdere vormen van psoriasis hebben?
- Waarom wordt mijn psoriasis vaak erger in de winter?
- Wordt psoriasis veroorzaakt door verkeerde voeding ?
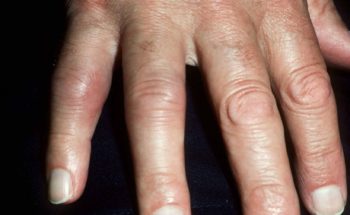
- Wat kan ik doen tegen psoriasis aan mijn nagels ?
- Wat heeft een keelinfectie met psoriasis te maken ?
- Kunnen zwangeren met psoriasis zonder problemen hormoonzalven gebruiken ?
- Heeft stress een slechte invloed op psoriasis ?
- Kan psoriasis ook op kinderleeftijd ontstaan ?
- Tast psoriasis alle delen van het lichaam aan ?
- Is psoriasis te genezen ?
- Is psoriasis erfelijk? Krijgen mijn kinderen later ook psoriasis ?
- Is psoriasis besmettelijk ?
- Wat veroorzaakt psoriasis ?
- Helpt een kuur aan de Dode Zee tegen psoriasis ?